ITI. FRANCISCO JOSE DE CALDAS
QUIMICA GENERAL E INORGANICA
DOCENTE WILSON MONTAÑA
El pH: El potencial de hidrógeno (pH) es un índice utilizado ampliamente en química, que expresa el grado de acidez o alcalinidad de una disolución acuosa. El pH está relacionado con la concentración iones de hidrógeno presentes en determinadas disoluciones. Este término fue acuñado por el bioquímico danés S. P. L. Sørensen (1868-1939), quien lo definió en 1909 como el opuesto del logaritmo en base 10 o el logaritmo negativo de la actividad de los iones de hidrógeno.
La notación pH se utiliza universalmente por lo práctico que resulta para evitar el manejo de cifras largas y complejas. En disoluciones diluidas, en lugar de utilizar la actividad del ión hidrógeno, se le puede aproximar empleando la concentración molar del ión hidrógeno, [H+] o [H3O+]. Por ejemplo, una concentración de [H3O+] = 1×10−7 M, lo que equivale a: 0.000 000 1 M y que finalmente es un pH de 7, ya que pH = –log[10−7] = 7.
En disolución acuosa, la escala de pH varía, típicamente, de 0 a 14. Son ácidas las disoluciones con pH menores que 7 (el valor del exponente de la concentración es mayor, porque hay más iones hidrógeno en la disolución). Por otro lado, las disoluciones alcalinas tienen un pH superior a 7. La disolución se considera neutra cuando su pH es igual a 7, por ejemplo el agua.
EL PH VIDEOS COMPLEMENTARIOS

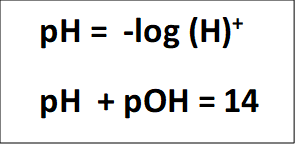
No hay comentarios:
Publicar un comentario